Over Global Pathology Support
GPS is goedgekeurd door de Voedsel en Waren Autoriteit (VWA) en ontving in 2005 de eerste “Endorsement of Compliance with the OECD principles of Good laboratory Practice”. Dit is onlangs toegekend door de Inspectie voor de Gezondheidszorg (IGZ), ook in 2020. Het is het enige bedrijf in Nederland dat zich toelegt op deze specifieke expertise en zich richt op het werken met bedrijven in de Life Science industrie om productveiligheid te ondersteunen.
Er is ook een “overload” aan werk met wereldwijd te weinig geaccrediteerde specialisten op het gebied van productveiligheid. Global Pathology Support wil groeien en zich ontwikkelen tot een “Centre of Excellence” in Nederland en een centrum worden voor specialisten op het gebied van veiligheidsmonitoring van geneesmiddelen en chemicaliën voor mensen.
Informeer naar de mogelijkheden voor biofarmaceutisch advies
Bel ons op +31 70 3142404 en ontdekToxicologische pathologie
Met betrekking tot het gebruik van geneesmiddelen afkomstig van de farmaceutische industrie en chemische producten van de chemische industrie, moet de ervaring van de gebruiker positief zijn en moeten de negatieve effecten zo klein mogelijk zijn. Om de effecten vast te stellen, wordt toxicologisch onderzoek uitgevoerd. Het doel van het onderzoek naar de toxiciteit van stoffen is om ziekten te voorkomen door grenswaarden vast te stellen waaronder het gezondheidsrisico verwaarloosbaar of onbestaande is.
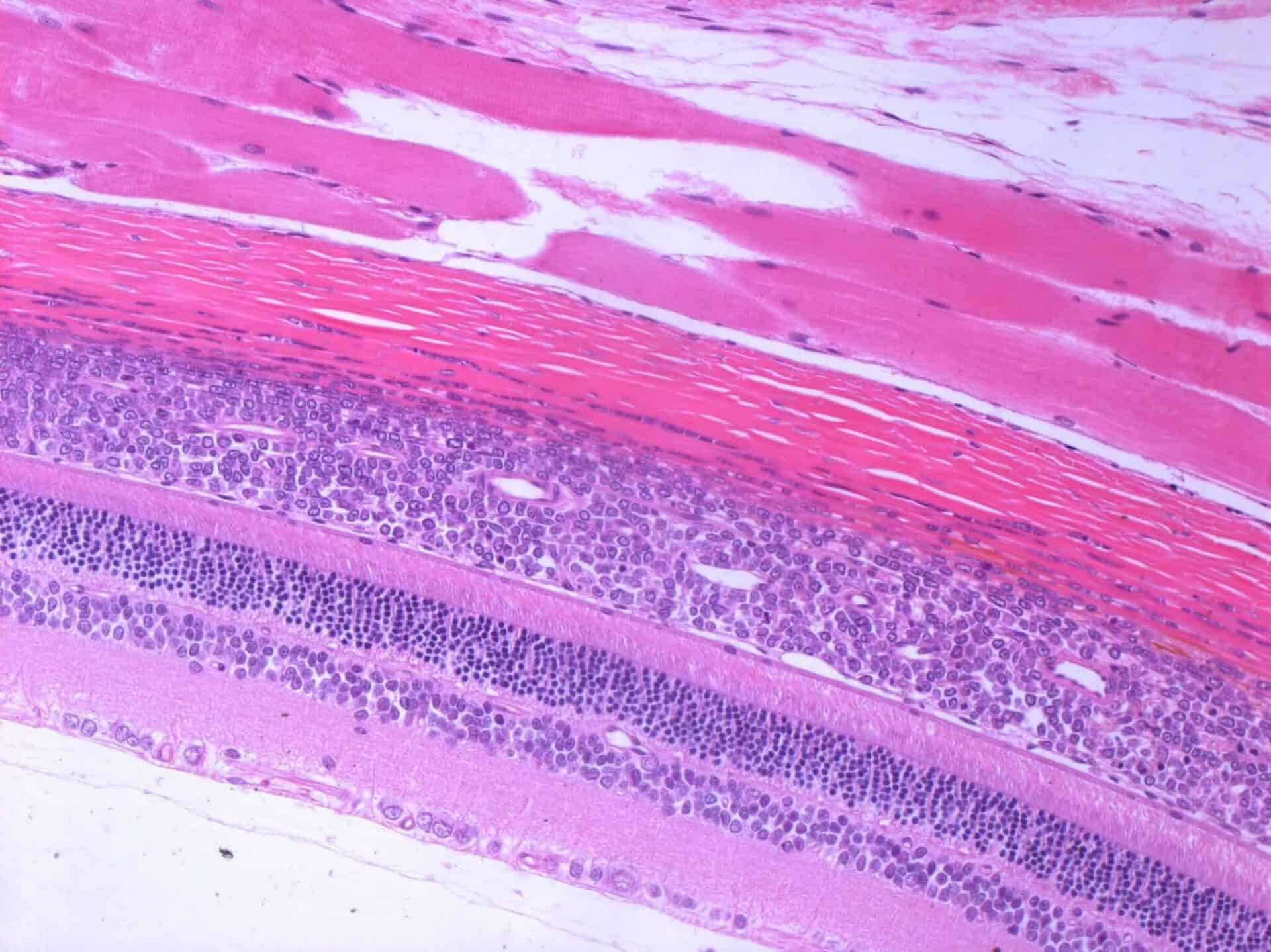
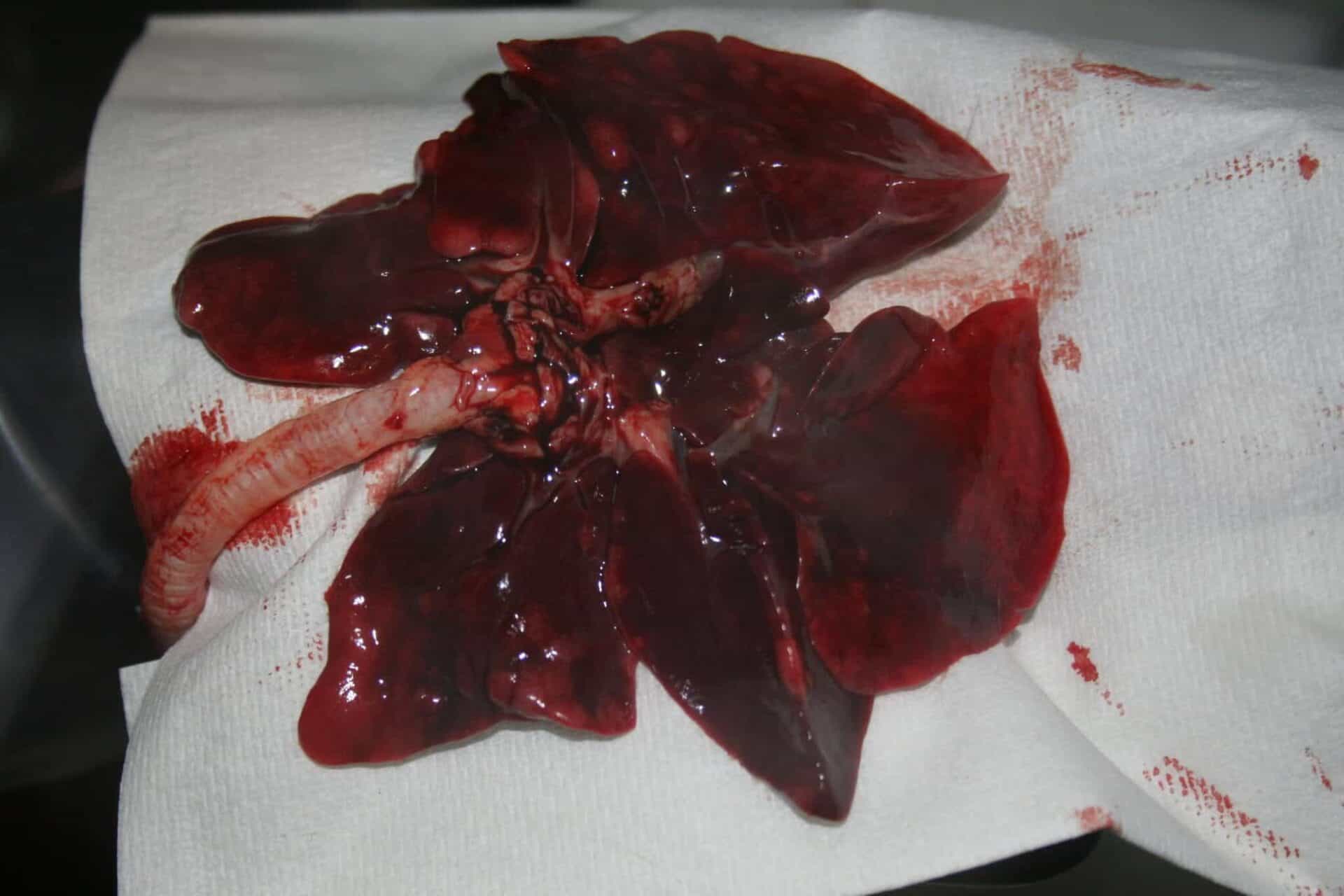
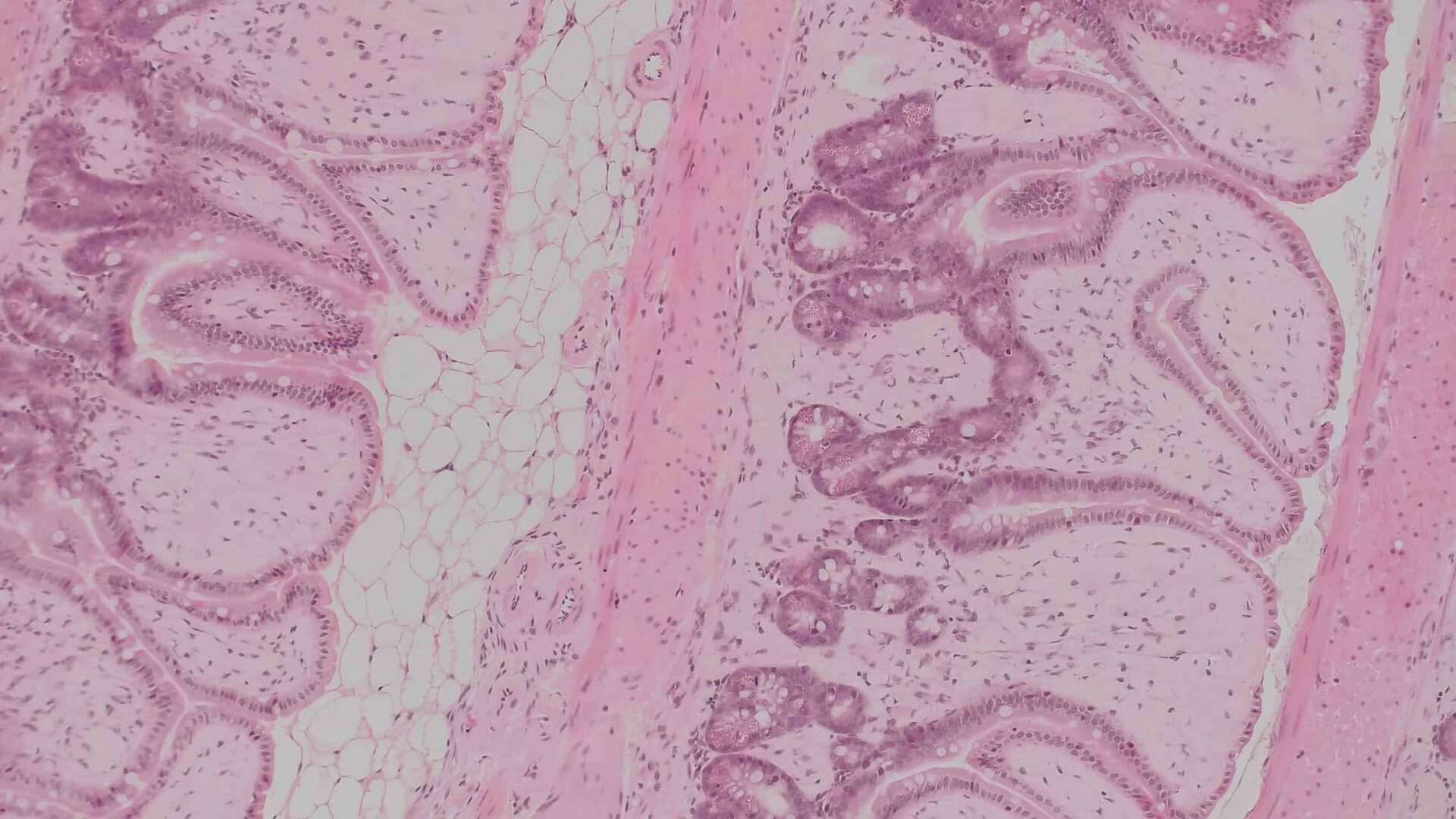
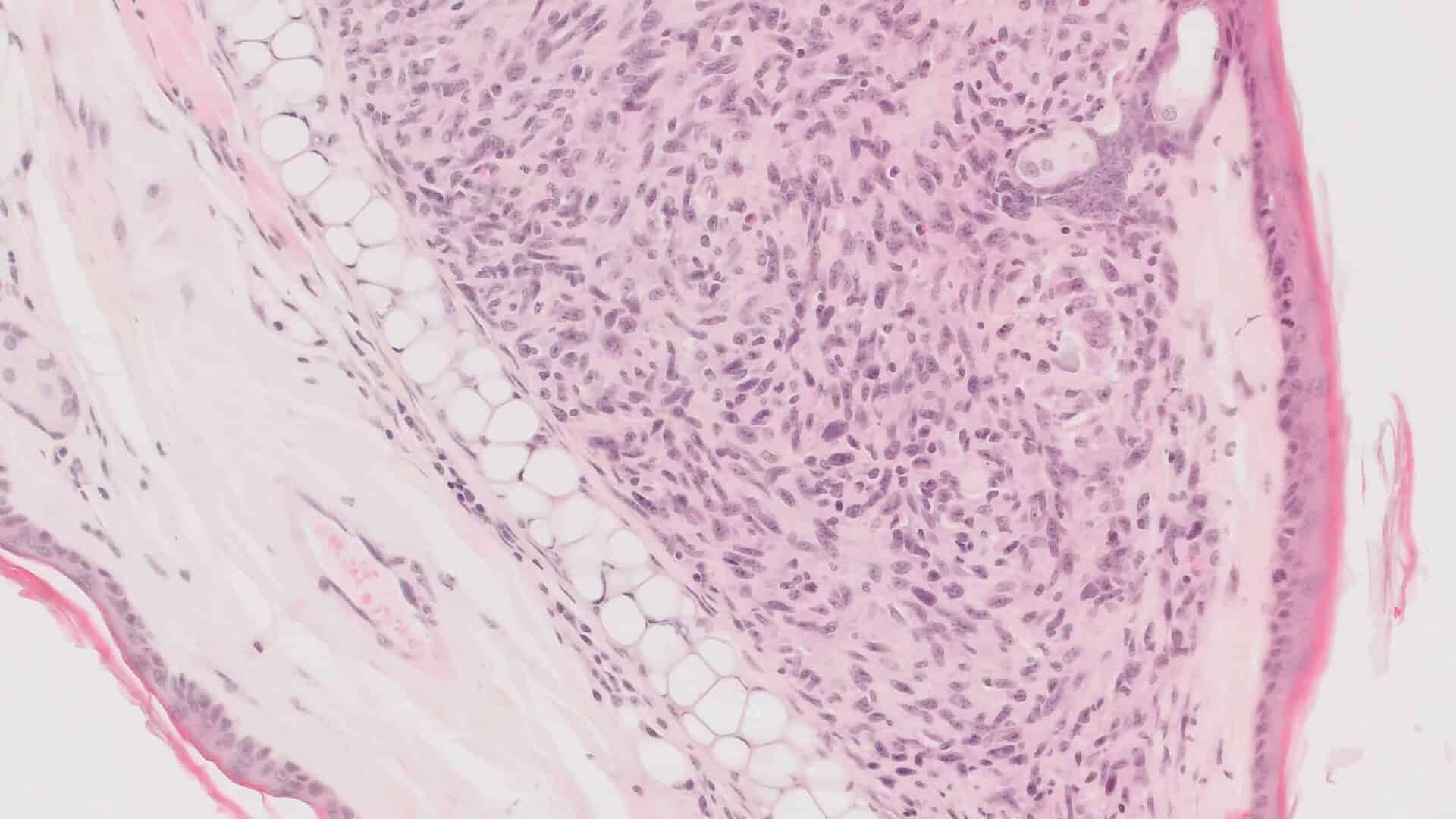
De (toxicologisch) patholoog speelt een sleutelrol bij het beoordelen van de veiligheid van geneesmiddelen, vaccins en chemicaliën. De nadruk ligt op de identificatie van pathologische veranderingen, de beoordeling van de relevantie van deze veranderingen en in het bijzonder de interpretatie van dierproeven in termen van toepassing op de mens (risicobeoordeling).
Nu de REACH-wet (EG 1907/2006) op 1 juni 2007 in werking is getreden, moet de impact op de gezondheid en het milieu extra worden getest op chemische veiligheid. De REACH-wetgeving (Registration, Evaluation and Authorization of Chemicals) vereist pathologie-expertise in zowel acute- als herhaalde-dosis toxiciteitstesten. GPS voldoet aan alle vereisten voor een goede veiligheidsevaluatie van onderzochte chemicaliën en doet dit volgens de OESO-richtlijnen op een GLP-conforme manier.
Rampen in deze eeuw, bijvoorbeeld met thalidomide (teratogene effecten) en het synthetische oestrogeen diethylstilbestrol in utero (kankerverwekkend) hebben ons geleerd hoe belangrijk het is om waakzaam te zijn voor de bijwerkingen van medicijnen. Ook verontreiniging van voedselbronnen door pesticiden en industrieel afval moet worden gecontroleerd. Voorbeelden van verbindingen waarvan is aangetoond dat ze kankerverwekkend zijn bij proefdieren (meestal in relatief hoge doses) en die in lage concentraties in de menselijke voeding terecht zijn gekomen, zijn bepaalde pesticiden (DDT en dieldrin) en industriële verontreinigende stoffen (polychloorbifenylen). Ook het feit dat steeds meer geneesmiddelen en chemische stoffen die al op de markt zijn, na het in de handel brengen uit de handel worden genomen, benadrukt het belang van veiligheidsbeoordeling.
Deze voorbeelden onderstrepen het belang van veiligheidsonderzoek voordat producten (medicijnen) op de markt komen. De (toxicologisch) patholoog heeft dus een belangrijke rol bij de risicobeoordeling als onderdeel van de integrale beoordeling van de veiligheid van geneesmiddelen op basis van dierproeven.
Het gebruik van conventionele toxicologische onderzoeken met pathologie is meestal voldoende om belangrijke bijwerkingen van geneesmiddelen te voorspellen en het veilige gebruik in klinische onderzoeken te ondersteunen. Door knaagdieren en niet-knaagdieren een maand lang te doseren met een nieuw geneesmiddel wordt meer dan 90% van de bijwerkingen die ooit zullen worden gedetecteerd in conventionele dierstudies geïdentificeerd. Onderzoek wees er ook op dat het percentage echt positieve concordanties (gevoeligheid) over het algemeen ongeveer 70% is, waarbij 30% van de toxiciteiten bij mensen niet voorspeld worden door veiligheidsfarmacologie of conventionele toxiciteitsstudies. Over- en ondervoorspelling op basis van diertoxiciteit komt ook voor. Daarom moet er rekening worden gehouden met de diersoort, het orgaan, de anatomie, de histologie en de klasse geneesmiddelen die worden onderzocht, in combinatie met mogelijke andere betrokken orgaansystemen, veranderingen in het orgaangewicht, hematologie, klinische chemie en andere belangrijke gegevens, om de juiste extrapolaties te maken bij de veiligheidsbeoordeling. De patholoog die betrokken is bij deze besluitvormingsprocessen heeft daarom een goede opleiding nodig (4 jaar postacademisch curriculum zoals goedgekeurd door de nationale registratiecommissies), ervaring en voortdurende training en National Board Certification door een erkende instelling.
Het bovenstaande illustreert het belang van pathologisch werk aan geneesmiddelen/vaccins, voedingscomponenten of chemicaliën, omdat het een goed inzicht kan geven in de veiligheid van de onderzochte producten wanneer hoge kwaliteitsnormen worden gehanteerd.